A rhodanid kálium egy mérgező anyag, amelyet az analitikai kémia során használnak
Rodanid kálium( a modern IUPAC - kálium-tiocianát név szerinti besorolása szerint) - szín és szag nélküli kristályok;finoman diszpergált állapotban fehér színt kapnak. Az anyag kesernyés, akut ízű, mérgező.A kálium-fáganid számos oldószerben, például vízben, amil-alkoholban és etanolban jól oldódik.
Az
szerzése Az anyagot csak kémiai úton lehet előállítani, természetes forrásból( vér és emberi nyálból) kivont - rendkívül költséges. A kálium-tiocianát szintéziséhez ammónium-tiocianát és kálium-hidroxid oldatokat( triviális név - kausztikus kálium) kell összekeverni.
A vizsgálat vontatás alatt történik, mert a felszabadított ammónia kémiai égési sérülést és mérgezést okozhat;Ezután a tisztított oldatot szűrjük, és a maradékot bepároljuk, így megkapjuk a kívánt anyag kristályait. Ha a terméket 70% -ra engedik fel és elegendő tiszta ammónium-tiocianát-mintát, ez a módszer nagyon hatásos.

Egy másik módszer a kén kálium-cianiddal történő megolvasztása, de ez a kálium-tiocianát előállítási módja nagyon veszélyes a cianid nagyfokú toxicitása miatt.
Az
alkalmazása A kálium-tiocianátot, annak származékait és oldatait különböző koncentrációkban alkalmazzák számos iparágban. Például:
- Textilipar.
- Filmfotó.
- Szerves szintézis.
- Analitikai kémia.
Az

- felhasználási területei A textiliparban. A kálium-tiocianát oldatot szövetek, például selyem, festés és feldolgozás során öltöztetik az anyag eredeti tulajdonságainak megőrzése érdekében.
- Szerves szintézisben. Néhány szerves anyagot, például tiokarbamidot, szintetikus mustárt és különböző színezékeket kálium-tiocianátból állítanak elő.Segítségével más tiocianátokat is előállíthatunk, például a réz-tiocianát-2-t.
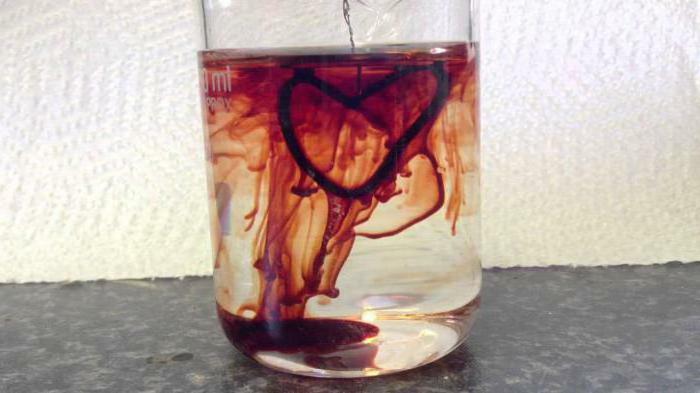
- Az analitikai kémiában a kálium-tiocianát oldatát használják a ferri-vas kationjainak meghatározására az anyagban. Egy szemléltető példa a reakció, amelyben a kálium-tiocianát és a vas-3-klorid szintén részt vesz, amelyet "vértől" is neveznek, amelyben a karmazsin piros hexacianoferrát 3 képződik;A triviális név a vörösvértest. Szintén a tiocianátokat ritka fémek, például tórium és lantán elválasztására használják. A kálium-fáganid és a vas-klorid a közelmúltban segített a mesterséges vér felvételében, de ez a módszer a számítógépes grafika bevezetése miatt a háttérben rejlik.
- A mezőgazdaságban erős inszekticideket kapnak a tiocianátok oldatából. Két lehetséges reakció létezik: az
- Az első a tiociángáz termelése a kálium só eltávolításával;A Rodan minden élő szervezet számára meglehetősen veszélyes gáz, és ritkán használják. Az
- A második a kálium-tiocianát feloldódása, a hidrolízis során felszabaduló hidrogén-cianid-hidrogén gyűjtése és a kapott anyagnak a cianogénhez való oxidációja. A cián nem kevésbé mérgező, de nehezebb gáz a fecskendőhöz képest, ezért gyakran használják inszekticidként.
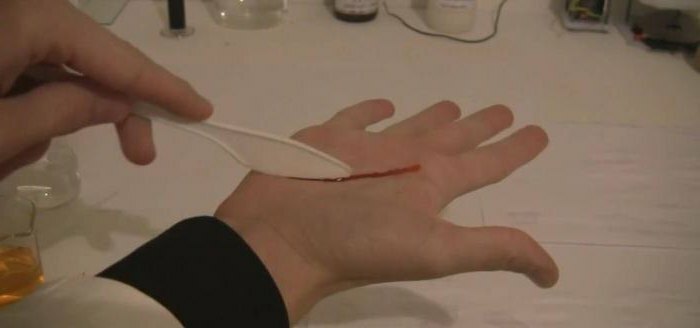
A kálium-fáganid mérgező anyag, amelynek halálos dózisa körülbelül 0,9 gramm anyag az emberi testtömeg kilogrammonként orálisan beadva.
Elérhetőség
A rhodanid kálium bármely vegyi áruházban megvásárolható, de kis mennyiségben a nagy toxicitás miatt. A reagens átlagos ára négyszáz rubel kilogrammonként, az értékesítés leginkább két kilogrammra korlátozódik.
Safety
Mérgező hatása miatt a kálium-tiocianátot különleges feltételek mellett, biztonsági előírásoknak megfelelően kell tárolni mérgező anyagok kezelésekor:
- Kristályokat és megoldásokat kálium-tiocianátot szigorúan tilos szájon át kell bevenni, és nagyon nemkívánatos behatolása megoldások magas koncentrációja a bázikus hatóanyag a bőrre.
- Annak ellenére, hogy a gyógyszer toxikus csak alkalmazásakor befelé munka az anyag kívánatos gumikesztyű köpenyes, és mint minden vegyi anyag alapvető biztonsági követelményeknek.
- kell elkülöníteni az anyag a gyermekek és a személyek, akik nem ismerik a laboratóriumi, mert ez okozhat kellemetlen incidensek a veszteség reagensek, visszaélés, és a hirtelen halál.
- Mivel az anyag nem éghető és elég stabil a levegőben, anélkül teheti meg, hogy az anyagot sötétben tárolná.szekrény. Kerülje a magas páratartalmat és a közvetlen napsugárzást, mert a bomlása a komponensek részeként károsíthatja a reagenseket. Szintén szokásos NFPA 704 rombos címkézése a következő szimbólumok: 3 0 0 W, ahol a 3( a kék cukorka) - toxicitás, 0( a vörös és sárga) - gyúlékonyság és reakciókészség, és W - jel vízzel való kölcsönhatás,amely a toxikus tiociánsav felszabadulása.
És ne feledje, a kémiai kísérletek elképesztőek és egyediek, de soha nem hagyják figyelmen kívül a biztonságot!
