Rodanid kalium er et giftig stoff som brukes i analytisk kjemi
Rodanidkalium( i henhold til den moderne nomenklaturen for IUPAC - kaliumtiocyanat) - krystaller som ikke har farge og lukt;I en fin spredt tilstand kjøper de en hvit farge. Stoffet har en bittert akutt smak, er giftig. Kalium-rodanid er lett løselig i mange oppløsningsmidler, slik som vann, amylalkohol og etanol.
Få
Stoffet oppnås bare kjemisk, det ekstraheres fra naturlige kilder( blod og menneskelig spytt) - ekstremt dyrt. For å syntetisere kaliumtiocyanat er det nødvendig å blande oppløsninger av ammoniumtiocyanat og kaliumhydroksid( trivielt navn - kaustisk kalium).
Testen utføres under trekkraft, fordi ammoniakk utgitt kan forårsake kjemiske forbrenninger og forgiftning;Deretter filtreres den rensede oppløsning og residuet inndampes for å gi krystaller av det ønskede stoffet. Når produktet slippes til 70% og en tilstrekkelig ren prøve av ammoniumtiocyanat, er denne metoden meget effektiv.

En annen metode er å smelte svovel med kaliumcyanid, men denne metoden for å oppnå kaliumtiocyanat er meget farlig på grunn av cyanids høye toksisitet.
Anvendelse av
Kaliumtiocyanat, dets derivater og løsninger med ulike konsentrasjoner i flere bransjer benyttes. For eksempel:
- Tekstilindustri.
- Filmbilde.
- Organisk syntese.
- Analytisk kjemi.
Anvendelsesområder for

- I tekstilindustrien. Kaliumtiocyanatløsning brukes til å kle på stoffer, for eksempel silke, under maling og behandling for å bevare materialets opprinnelige egenskaper.
- I organisk syntese. Noen organiske stoffer, som tiourea, syntetisk sennepolje og forskjellige fargestoffer, syntetiseres fra kaliumtiocyanat. Også med dets hjelp oppnås andre tiocyanater, for eksempel kobbertiocyanat-2.
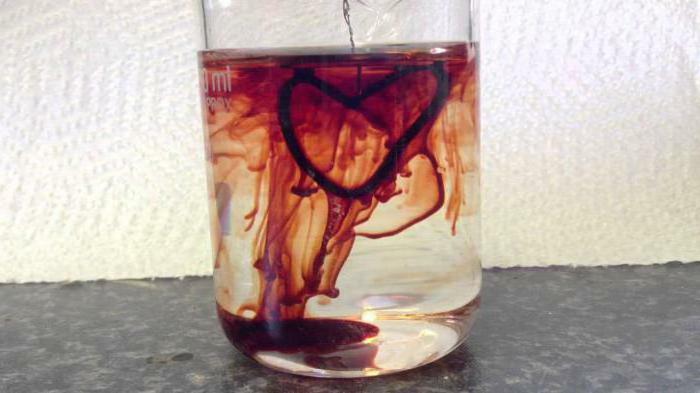
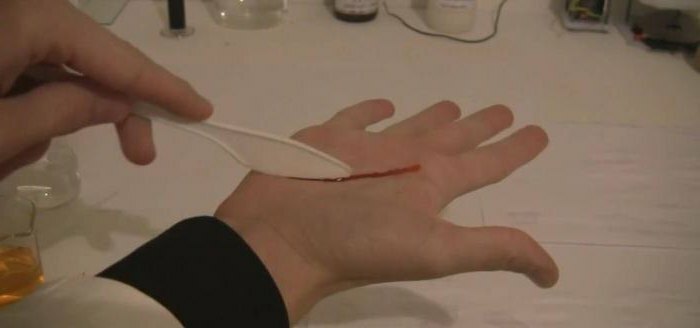
- I analytisk kjemi brukes løsningen av kaliumtiocyanat til å bestemme kationer av jernholdig jern i stoffet. Et illustrerende eksempel er reaksjonen hvor kaliumtiocyanat og jern-3 klorid også er involvert, også kalt "blod fra vann", hvori krystallet rødt heksacyanoferrat 3 dannes;Det trivielle navnet er rødt blodsalt. Også, thiocyanater brukes til å skille sjeldne metaller som thorium og lantan. Kalium-rodanid og jernklorid har nylig hjulpet til å skaffe kunstig blod for filming, men denne metoden går til bakgrunnen på grunn av innføringen av datagrafikk i filmindustrien.
- I landbruket oppnås sterke insektsmidler fra løsninger av thiocyanater. Det er to mulige reaksjoner:
- Den første er produksjonen av thiocyan gass ved å fjerne kalium fra salt;Rodan er en ganske farlig gass for alle levende organismer og brukes sjelden.
- Den andre er oppløsningen av kaliumtiocyanat, oppsamlingen av hydrocyansyre frigjort under hydrolysen og oksydasjon av det oppnådde stoffet til cyanogenet. Cyan er ikke mindre giftig, men tyngre gass sammenlignet med sprøyten, og brukes derfor ofte som insektmiddel.
Kaliumrodanid er et giftig stoff hvis dødelig dose er ca. 0,9 gram stoff per kilo kroppsvekt ved oral administrering.
Tilgjengelighet
Rodanid kalium kan kjøpes hos enhver kjemisk butikk, men i små mengder på grunn av den høye toksisiteten. Gjennomsnittlig pris på et reagens er fire hundre rubler per kilo. Salget er oftest begrenset til to kilo i en hånd.
Sikkerhet
På grunn av dets toksisitet, skal kaliumtiocyanat oppbevares under spesielle forhold for sikkerhetskrav ved håndtering av giftige stoffer:
- Krystaller og oppløsninger av kaliumtiocyanat er strengt forbudt å tas oralt, og er meget uønsket inntrengning av oppløsninger med en høy konsentrasjon av den basiske substans til huden.
- Til tross for det faktum at medikamentet er toksisk bare ved påføring indre arbeide med stoffet er ønskelig i gummihansker frakk, og som med alle kjemikalier på grunnleggende sikkerhetskrav.
- bør isolere stoffet av barn og personer som ikke har kjennskap til et laboratorium, da dette kan føre til ubehagelige hendelser med tap av reagenser, misbruk, og plutselig død.
- Siden ikke-brennbart stoff, og er tilstrekkelig stabile i luften, er det mulig å håndtere lagring substans i mørket.tørt skap. Unngå høy luftfuktighet og direkte sollys, da det kan skade reagenset på grunn av dekomponering i dets bestanddeler. Også standard NFPA 704 ortorombisk merkingen har følgende symboler: 3 0 0 W, hvori 3( en blå pastill) - toksisitet, 0( for rød og gul) - brennbarhet og reaktivitet, og W - mark for vekselvirkning med vann,som er frigjøringen av giftig thiocyaninsyre.
Og husk, kjemiske eksperimenter er fantastiske og unike, men aldri se bort fra sikkerhetsteknikker!
