Rodanidkalium är en giftig substans som används i analytisk kemi
Rodanidkalium( enligt den moderna nomenklaturen för IUPAC - kaliumtiocyanat) - kristaller som inte har färg och lukt;i ett finfördelat tillstånd förvärvar de en vit färg.Ämnet har en bittert akut smak, är giftigt. Kalium-rodanid är lättlöslig i många lösningsmedel, såsom vatten, amylalkohol och etanol.
Få
Ämnet erhålls endast kemiskt, det extraheras från naturliga källor( blod och humant saliv) - extremt dyrt. För att syntetisera kaliumtiocyanat är det nödvändigt att blanda lösningar av ammoniumtiocyanat och kaliumhydroxid( trivialt namn - kaliumkalium).
Testet utförs under drag, eftersom ammoniak som frigörs kan orsaka kemiska brännskador och förgiftning. Därefter filtreras den renade lösningen och återstoden indunstas för att ge kristaller av den önskade substansen. När produkten frisätts till 70% och ett tillräckligt rent prov av ammoniumtiocyanat är denna metod mycket effektiv.

En annan metod är att smälta svavel med kaliumcyanid, men denna metod för att erhålla kaliumtiocyanat är mycket farligt på grund av cyanids höga toxicitet.
Användning av
Kaliumtiocyanat, dess derivat och lösningar med olika koncentrationer i flera branscher används. Till exempel:
- Textilindustrin.
- Filmbild.
- Organisk syntes.
- Analytisk kemi.
Användningsområden för

- I textilindustrin. Kaliumtiocyanatlösning används för att klä på tyger, till exempel - silke, under målning och bearbetning för att bevara materialets ursprungliga egenskaper.
- I organisk syntes. Vissa organiska ämnen, såsom tiourea, syntetisk senapsolja och olika färgämnen syntetiseras från kaliumtiocyanat. Också med hjälp erhålles andra tiocyanater, t ex koppartiocyanat-2.
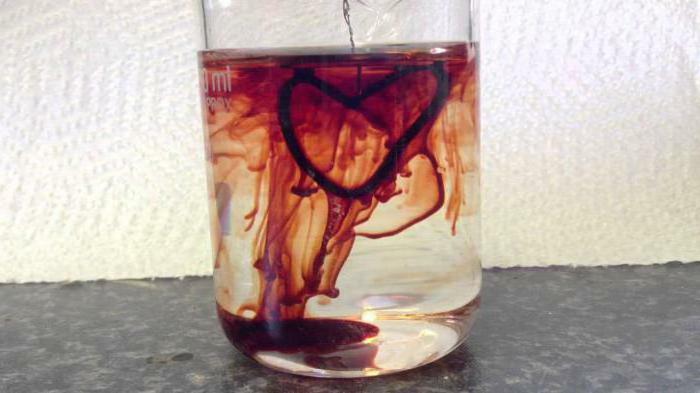
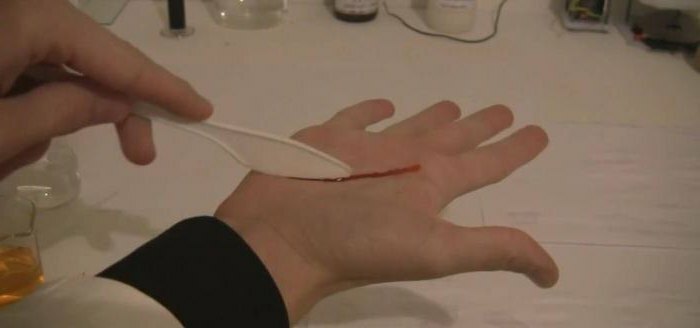
- I analytisk kemi används lösningen av kaliumtiocyanat för att bestämma katjoner av järnjärn i ämnet. Ett illustrativt exempel är reaktionen i vilken kaliumtiocyanat och järn-3-klorid också är inblandade, även kallade "blod från vatten", i vilket crimson red hexacyanoferrate 3 bildas;Det triviala namnet är rött blodsalt. Dessutom används thiocyanater för att separera sällsynta metaller som torium och lantan. Kaliumrodanid och järnklorid har nyligen hjälpt till att erhålla konstgjort blod för filmning, men denna metod går till bakgrunden på grund av införandet av datorgrafik i filmindustrin.
- I jordbruk erhålls starka insekticider från lösningar av tiocyanater. Det finns två möjliga reaktioner:
- Den första är produktionen av tiocyangas genom att ta bort kalium från salt;Rodan är en ganska farlig gas för alla levande organismer och används sällan.
- Den andra är upplösningen av kaliumtiocyanat, samlingen av hydrocyansyra befriad under hydrolysen och oxidation av den erhållna substansen till cyanogenet. Cyan är inte mindre giftig, men tyngre gas jämfört med sprutan, och används därför ofta som insekticid.
Kaliumrodanid är en giftig substans vars dödliga dos är ca 0,9 gram substans per kg kroppsvikt vid administrering oralt.
Tillgänglighet
Rodanidkalium kan köpas på vilken kemisk butik som helst, men i små kvantiteter på grund av hög toxicitet. Genomsnittspriset för ett reagens är fyra hundra rubel per kilo, försäljningen är oftast begränsad till två kilo i ena handen.
Säkerhet
På grund av dess toxicitet måste kaliumtiocyanat förvaras under särskilda förhållanden för säkerhetskrav vid hantering av giftiga ämnen:
- Kristaller och lösningar av kaliumtiocyanat är strängt förbjudet att tas oralt och är i hög grad oönskad inträngning av lösningar med en hög koncentration av den basiska substansen till huden.
- Trots att läkemedlet är toxiskt endast vid tillämpningen inåt arbete med substansen är önskvärd i gummihandskar labbrock, och som med alla kemikalier på grundläggande säkerhetskrav.
- bör isolera ämnet barn och personer som inte har kunskap om ett laboratorium, eftersom detta kan orsaka obehagliga incidenter med förlusten av reagens, missbruk, och plötslig död.
- Eftersom oantändliga substans och tillräckligt stabil i luften, är det möjligt att hantera lagring substansen i mörker.torr garderob. Undvika hög luftfuktighet och direkt solljus, vilket kan hända på grund av försämring av reagenset sönderdelningen av dess komponentdelar. Också standard NFPA 704 ortorombisk märkning har följande symboler: 3 0 0 W, varvid tre( en blå sugtablett) - toxicitet, 0( för röd och gul) - brandfarlighet och reaktivitet, och W - märket för interaktion med vatten,som frigörs giftiga tiocyansyra.
Och kom ihåg, kemiska experiment - det är fantastiska och unika, men aldrig försumma säkerhetsåtgärder!
